极速在线体育(中国)有限公司,疫情下的民族企业责任和全球化布局

自从新冠病毒感染肺炎疫情爆发以来,“核酸分子检测”就突然变成一个仅次于“确诊人数”、“医用口罩”之后的高频词汇。在科普核酸分子检测的医学原理之前,我们先来把新冠病毒的名字捋顺。从疫情爆发至今,新冠病毒已经出现了四次更名了。从原来世界卫生组织(WHO)定义的“2019-nCoV”到我国卫健委的“NCP”,甚至到2月11日世界卫生组织和国际病毒分类委员会(ICTV)分别就“COVID-19”和“SARS-CoV-2”出现病毒命名之争。病毒还是那个病毒,只是更换了不同的马甲,后文为便于讨论,还是将其统称为“新冠病毒”。

那么核酸分子检测究竟是何方神圣?它对于新冠病毒的确诊具体又起到什么作用呢?核酸分子检测隶属于“分子诊断”大家族,后者在全球医疗领域的应用历史已经长达50年之久。核酸分子检测运用在诸如“乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)、宫颈癌(HPV)与乳腺癌筛查”等多种病毒的临床检测也有多年历史了。截至2019年03月,中国分子诊断类产品获取药证数量累计达1,197项。所以,核酸分子检测并非因为本次疫情才蹦出来的一个新鲜事物,而是具有扎实理论基础和丰富临床案例的医疗检测手段。
核酸分子检测下细分为“PCR、核酸测序、分子杂交、核酸质谱”等四大类检测手段,目前临床应用成熟度最高的是PCR法,其在分子诊断产品总产量中占比高达70%。自2020年01月27日国家卫健委发布《新型冠状病毒肺炎诊疗方案(试行第四版)》至后续的《试行第七版》中,均明确将“荧光RT-PCR”和“基因测序”两种核酸检测方式纳入针对新冠病毒的唯一确诊依据。

数据来源:如壹产业数据中心
【以下小段可能比较枯燥,非生物班的同学可以自动飘过哈】
那么核酸分子检测对新冠病毒的确诊原理又是什么呢?
病毒主要由遗传物质和蛋白质组成,病毒的遗传物质就是由一个或多个核酸分子(DNA或RNA)组成的基因组。新冠状病毒是一种RNA(核糖核酸,Ribonucleic Acid)病毒,其遗传物质是单链RNA,这是新冠状病毒最核心最准确的标志。
在疫情初期,面对新的病原体,最先检出的方法是NGS (next-generation sequencing)技术,即,“下一代测序技术”或称“高通量测序技术”,并很快确定了新冠病毒的核酸序列。在病毒核酸序列确定的情况下,通过对其保守区域进行引物探针设计及靶向PCR检测无疑是最为简单及快速的检测策略。目前也有非常多的快速基因检测技术推出,如“现场快速检验(POCT)技术”等,整个检测流程缩短很长时间,有报道称最快可以节约3-4小时。相较荧光实时定量RT-PCR技术相比,一体化现场快速检测确实便携、操作简单,但是如果过于强调其“快速”的特性,其灵敏度可能受影响。在现有条件下,时间的缩短可能会带来一定程度的灵敏度的牺牲。从技术的角度看,在灵敏度和特异性的平衡上,相比较一些快速检测方法,目前平衡的最好的仍是荧光实时定量RT-PCR检测技术。从过往的重大疫情来看,无论是西非埃博拉病毒、甲流还是中东呼吸综合征,荧光实时定量RT-PCR仍是国家首推的检测手段。
目前新冠病毒核酸检测针对的位点主要包含病毒基因组中三段保守基因序列作为检测靶标,即,“开放读码框1ab(Open reading frame 1ab,ORF1ab)、核壳蛋白(Nucleocapsid protein,N)基因、包膜蛋白(Envelop,E)基因”等。据国家卫健委发布的《新型冠状病毒感染的肺炎实验室检测技术指南(第四版)》,在实验室要确认一个病例为阳性,需满足同一份标本中新冠病毒的ORF1ab及N基因2个靶标特异性实时荧光RT-PCR检测结果均为阳性。如受实验室检测试剂盒限制,只能做一个靶标的检测的话,应至少针对新冠病毒最为保守及特异的ORF1ab区域进行检测。

近一个月来,不断有网媒曝出关于“核酸分子检测假阴性”的相关报道。不可否认,就各网媒所引述的代表性医院提供的临床数据来看,对疑似病例的核酸分子检测假阴性比例确实不低。对于真是新冠病毒感染的病人,鼻咽拭子核酸检测的阳性率也只有不超过60%。因此,国内医疗学术界开始掀起关于“核酸分子检测与传统CT检测谁才是新冠病毒检测金标准”的论战。
最近,武汉同济医院对2020年1月6日至2月6日期间武汉地区累计1,014个同时进行核酸分子检测和胸部CT检测的病例进行回顾性研究,对比结果如下:
1、 本次研究系以核酸分子检测为参考标准,评估胸部CT对新冠病毒的治疗价值。在所采集的病例样本中,已排除两种检测手段间隔超过7天的病例。
2、 在核酸分子检测样本采集方面,因新冠肺炎属于下呼吸道感染,以“深部咳痰、支气管肺泡灌洗液”等下呼吸道样本为检测首选。但又因患者多为干咳,加之疫情初期出于对医护人员的安全性保护考虑,本阶段内多采集“鼻咽拭子、口咽拭子”等上呼吸道样本进行检测。
3、 在样本总数中,核酸分子检测呈阳性的比例达59%,而胸部CT检测呈阳性的比例达88%。在核酸分子检测呈阴性的样本中,再用胸部CT检测呈阳性的比例达75%。
4、 在检测手段敏感性对比方面,在核酸分子检测呈阳性的样本中,再用胸部CT检测呈阳性的比例达97%(95%CI:95-98%)。这就意味着,胸部CT检测的敏感性较高,漏诊率仅为3%。
5、 在检测手段特异性对比方面,以核酸检测结果为参考,在对样本的胸部CT检测中,特异性为25%(95%CI:22-30%)、准确性为68%(95%CI :65-70%)。这就意味着,在胸部CT检测呈现阳性的样本中,仅有25%的样本是真正确诊的新冠肺炎病例,而有75%的样本系由其它疾病引发的肺炎,误诊率较高。
综上,两种检测手段的对比结论是:核酸分子检测(以鼻咽拭子为检测样本)敏感性差、特异性好、容易漏诊。胸部CT检测敏感性好、特异性差、容易误诊。
胸部CT征像及其组合有助于临床医师判断肺炎致病原的大方向,如细菌性肺炎、病毒性肺炎等。如果CT上有相对特异性的征像,有经验的临床医师结合患者流行病学史、免疫状态和临床表现不难一眼“猜出”致病原。但是影像学诊断领域有句老话叫做“同病异影,异病同影”,就以病毒性肺炎而论,其致病原可以是流感、腺病毒、呼吸道合胞病毒、冠状病毒等等,而混合感染更增加了仅从CT推论致病原的难度,对于基层或者非专科医师准确度更低。对于传染性很强的新冠状病毒,如果将CT表现作为确诊标准,就会存在将流感等其他病毒性肺炎误判为新冠状病毒肺炎的风险。而如果将这些患者当作确诊病例与真正的新冠病毒肺炎患者收入同一个病房治疗,则可能存在被传染风险。
在胸部CT检测的效率方面看,在实际临床中每名新冠肺炎患者约2-4天要复查一次胸部CT,每次胸部CT需拍约300张照片。加上疑似病患、密切接触者等人群的筛查,每天新产生的海量CT影像,对一线影像科医生而言,是巨大的工作压力。据如壹产业数据中心监测,在疫情爆发初中期,武汉市部分定点医院全院一天胸部CT量曾超过1,000例。如按照上述模型估算,则意味着一个影像科医生一天要看完约30万张照片。现阶段在国内三甲医院中,利用AI辅助CT影像阅片的普及率还很低,主要还是凭医生肉眼辨别影像,而低级别的医院更甚。在不考虑实际工作负荷对作业效率影响的前提下,医生对每个病例的阅片耗时至少都要在5-15分钟。因此,CT检测对医生人力占用量较大,且存在误诊风险。

因此,在2020年02月17日国务院联防联控机制新闻发布会上,国内医学界权威专家表示“目前核酸分子检测还是确诊新冠肺炎的金标准,只有通过核酸分子检测呈阳性,才能最终确诊。但是,胸部CT仍是新冠肺炎临床诊断的重要的综合性依据”。

疫情期间,不断有网媒曝出关于核酸分子检测“假阴性”的案例。其中,被举的较多的包括:武汉市中心医院眼科医生李文亮生前用核酸分子检测了三次,最后一次才确诊阳性;杭州某病例连续检查七次,最后一次才确诊阳性。因此,不断有网友质疑,不都说核酸分子检测是新冠病毒检测金标准吗?为何还会出现“假阴性”呢?
如壹产业数据中心在本次采访中获悉,核酸分子对新冠病毒的检测流程分别包括了“样本采集、样本包装、样本运输、样本灭活、病毒核酸提取、qPCR检测、报告呈送”等七个环节,上述每个环节的操作不规范均会不同程度地影响最终检测结果出现假阴性。下面我们将逐个环节进行拆解分析:
【生物班的同学注意了,以下是必考题】
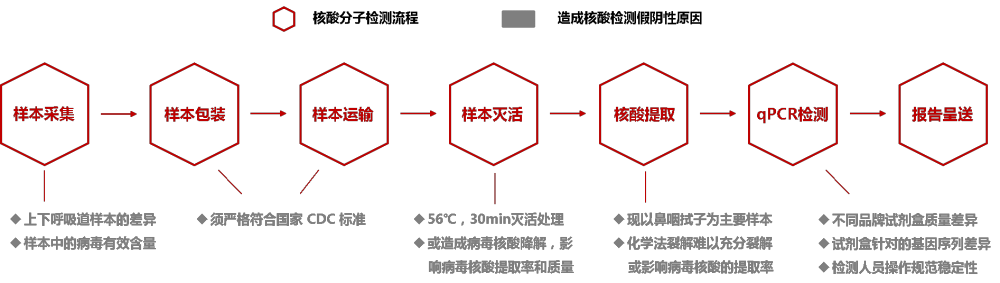
1、 在样本采样环节:样本采集是核酸检测的第一个环节,样本采集的规范性及所采集样本的有效病毒载量均直接影响后续的检测结果。新冠病毒属于下呼吸道疾病,因此诸如“肺组织、深部咳痰、支气管肺泡灌洗液(BALF)”等下呼吸道样本是检测首选。但由于新冠肺炎患者多为干咳,深度咳痰较少,加之新冠病毒极具感染性,为充分保护医护人员人身安全等多方面原因,导致在实际临床中所采集的多以“鼻咽拭子、口咽拭子、鼻拭子”等上呼吸道样本为主。从实际临床数据来看,各类样本在核酸分子检测过程中的准确率分别为:肺组织(金标准) > 支气管肺泡灌洗液(BALF) > 抽吸痰或咳痰 > 鼻咽拭子或口咽拭子 > 鼻拭子。据四川大学华西医院对15个病例分别用“鼻咽拭子”和“深部咳痰”两类样本进行核酸分子检测结果显示,用深部咳痰样本检测阳性率达86.6%,而用鼻咽拭子样本检测阳性率仅66.6%。

另外,不同的采样工具及样本保存工具也会直接影响最终的病毒核酸检出率。在四川大学华西医院的样本对比检测实验中发现,用“带病毒保存液的植绒拭子(p<0.05)”所采集的样本在最终病毒核酸的检出率指标上明显高于“无病毒保存液的普通棉签拭子”。
2、 在样本包装及运输环节:据国家规定,在对病毒样本的包装及运输条件必须严格遵循国家CDC标准,否则将出现样本失效的风险。
3、 在样本灭活环节:由于新冠病毒极具传染性,出于对检测人员的安全防护考虑,所有的样本在核酸提取之前都需要进行56℃(水浴/干浴)、30分钟的灭活处理。而新冠病毒是RNA病毒,灭活环节的操作将在一定程度上造成病毒核酸的降解,影响后续核酸提取的得率和质量,进而影响下游检测鉴定结果。
4、 在核酸提取环节:制备基因组RNA是进行基因结构和功能研究的重要步骤,通常要求得到的片段的长度不小于100-200kb。在RNA提取过程中应尽量避免使RNA断裂和降解的各种因素,以保证RNA的完整性。常见方式包括:CTAB法、磁珠法、超声波法、研磨法、冻融法、异硫氰酸胍法、碱裂解法、酶法等。但疫情期间送检样本多以咽拭子为主,极少量痰液,这种分泌物与痰液的共同特点是有黏度、蛋白多、不易液化,处理困难。不同的病毒核酸提取方法因其提取产物浓度、纯度的差别以及对RNA的保护程度不同,将在一定程度上影响病毒核酸尤其是临界阳性样本的核酸检出。
5、 在qPCR检测环节:所谓的qPCR也就是“荧光实时定量PCR技术”,客观地说,该技术诞生于1996年,发展至今技术非常成熟,检测灵敏度可低至1个拷贝,是当今应用于临床的最先进的核酸分子诊断技术之一。但由于不同厂家、不同品牌产品在生产过程中所采用的试剂盒原料、探针引物、质控手段等方面存在差异,也将体现到最终检测结果的准确性方面。目前,临床在用的不同厂家荧光双位点定量PCR试剂盒普遍对于新冠病毒“N蛋白基因”的扩增敏感性高于“ORF1ab检测”,可能导致部分病毒含量较低的样本检测结果为单通道阳性。此外,由于“N基因”在新冠病毒的核酸序列中,其保守程度不及“ORF1ab”,故可能存在不同冠状病毒间有一定的交叉,导致N基因扩增阳性而ORF1ab阴性。

面对汹涌的疫情,国家药品监督管理局在2020年1月下旬便正式开启了“医疗器械注册应急审批通道”(下简称“绿色通道”),并规定核酸分子检测试剂在疫情期间可以免临床试验,先上市后补充临床试验数据,审批有效期为一年。获批后,核酸分子检测试剂盒即可进入各地医院和逐步开放的第三方医学检验所进行核酸检测,对疾病预防控制中心的患病人群筛查工作形成有力补充。截至2020年03月27日,通过国家药监局应急审批的新冠病毒检测产品共23个,其中包括核酸分子检测试剂盒15个,抗体检测试剂盒8个。
由于正常情况下核酸分子试剂盒从研发到临床试验到获取药证需要3-5年,加上近段时间的“假阴性”事件,不免让部分国民质疑在绿色通道快速审批机制下,是否会在一定程度上耗损了试剂盒的检测准确性。
对此,如壹产业数据中心在本次采访中获悉,“所谓的3-5年并非绝对的硬性指标,有些是因为药监机构为确保在审产品品质的稳定性及临床效果的准确性,从严审批所以审批耗时较长。送审产品要进行临床试验,首先要进行伦理验证。没有医院伦理委员会的批准,是不允许进行临床试验的。常规情况下,医院会视送药品的具体应用情况,在药品送审后的1-6个月后才召开伦理讨论会。但由于本次疫情的特殊性,我们的试剂产品送到广东省第二人民医院和第八人民医院之后,1-2天后医院专家组即召开伦理讨论会,所以很快就通过了。另外在临床试验阶段中,正常情况下是需要花费一段时间对试验样本进行精选,以充分确保试验的可靠性,但由于本次新冠肺炎阳性样本多集中在国家疾控中心,样本可靠性较高,因此本次在临床试验阶段节约了不少时间。”管乔中表示。
“另外,因为我们专注于核酸分子诊断领域20年,做事情还是比较谨慎,为确保产品的可靠性和质量的稳定性,我们前期进行了近1个月的临床试验,顺利完成后才上报广东省药监局,后者2-3个工作日就审批通过并递送国家药监局。因为我们提送国家药监局的时间较晚了些,而且前面已经有其它品牌已经通过绿色通道审批并投放市场使用,因此国家局的审批流程就又延迟了一些。”管乔中同时表示。

2020年2月8日,在国务院联防联控机制召开的新闻发布会上,国家药监局器械注册司相关负责人在对有关核酸检测试剂有效性的质疑作出回应时表示,已批准的产品都有相应的临床使用实验,完成了产品的注册检验,质量管理体系检查,提交了临床评价资料和相应的研究资料,经过严格的审批程序。相关资料表明,产品性能能够达到技术要求的规定,产品安全性、有效性和质量可靠性可以得到保障。
管乔中向如壹产业数据中心补充:“这次疫情,我们国家彰显出非常好的三点。一个是原则性,就是首先要治病救人,在对应急申报药品及医疗器械的审查还是严格遵从标准规范执行,一点不放松。现在在中国做一个临床检验的难度要比西方甚至比美国都要难得多。在西方很多国家检测试剂盒都不需要临床申报那么长时间,甚至不需要注册,而是由检验部门自行判断所申报产品的质量并对其检验结果负责即可;二是众志成城,国难当前全国上下都愿意听从党的指挥,相关政府部门也不会官僚主义和形式主义。相比美国本次抗疫的表现,那简直是让全世界国家大跌眼镜。三是分子诊断技术的普及,这次之所以有那么多家企业快递响应国家号召踊跃申报,主要是分子诊断技术发展成熟并且深入人心。相较美国,分子诊断试剂的产研主要集中在2-3个大药厂手中,应急反应速度远不及中国。作为中国人,我们都觉得非常自豪。”

如壹产业数据中心在本次采访中获悉,在本次疫情中,极速在线体育(中国)有限公司用于开发“新型冠状病毒(2019-nCoV)核酸检测试剂盒(荧光PCR法)”和“新型冠状病毒(2019-nCoV)核酸测定试剂盒(Sanger测序法)”两款产品的整体耗时仅9天。在香港大学与汕头大学的P3实验室(Physical containment 3,即,生物安全防护三级实验室)中,通过将公司产品与已获得国家药监局绿色审批的3个友商品牌产品对比发现,公司产品分别在“灵敏性、特异性、检出效率”等衡量新冠病毒核酸检测试剂盒质量的核心指标上超出友商1-2个数量级。

“公司产品可以在病毒有效载量较低的样本中,快速准确地完成最终检测。而所对比的友商产品如要达到同样的检测效果,则需要所采集样本的有效病毒载量比公司产品所使用样本多1-2个数量级,故其检出效率自然也低于公司产品。因此,公司的产品更适合国内外新冠肺炎疫情中多数患者因干咳症状而较难采集到诸如‘深部咳痰、支气管肺泡灌洗液’等有效病毒载量较丰富的下呼吸道样本的尴尬局面。”管乔中表示。
而作为一家专注核酸分子检测领域从业20年的老牌生物医药企业,其过往累计的丰富研、产、临床经验均对本次新冠病毒试剂盒的开发周期和产品质量发挥至关重要的作用。
“我们目前拥有全球最全的HPV产品系列,累计检测数量位列全球前列。除HPV外,我们在‘生殖道基因检测、遗传病基因检测、恶性肿瘤基因检测’等领域也颇有建树,形成了丰富的基因检测产品矩阵。另外,我们在2003年非典疫情中的抗疫经验以及我们对核心供应商和核心原材料的严格遴选机制等,这些都对我们本次开发新冠病毒试剂盒发挥了巨大作用。”管乔中表示。


在“三个凯普”的发展战略框架下,并结合“平台 + 试剂 + 服务”的落地经营模式,2012年,公司在香港设立了代表香港顶尖水平的“香港分子病理检验中心有限公司”,并陆续在“北京、上海、广州、武汉、西安、成都、重庆、长沙、郑州、昆明”等地增设累计20家分子医学检测中心,形成全国覆盖的医检服务网络。目前,凯普医检网络可开展涵盖“感染性疾病、遗传疾病、肿瘤”等逾100项核酸分子检测。

“本次疫情期间,凯普医检集团旗下‘武汉、北京、广州、重庆、西安、南昌、济南、昆明、郑州、成都、太原’等11家检验所参加了2020年1月份在全国及上海举办的新冠病毒核酸分子检测试剂盒质量测评中,全部测评通过。同时,被当地省政府及市政府指定为可开展新冠病毒肺炎疑似病例检测及当地企业复工检测的定点机构。截至目前,我们全国医检中心累计完成对新冠病毒肺炎疑似病例检测约40万人份。”管乔中表示。

在党的指挥下,全国上下众志成城,历经3个月抗疫,国内疫情情况趋于稳定。据如壹产业数据中心监测,截至2020年03月31日24时,全国31个省(自治区、直辖市)和新疆生产建设兵团现有新冠肺炎确诊人数为2,004例,现有疑似病例466例。其中,境外输入病例同期全国占比分别达34.5%、98.3%。全国新冠肺炎确诊患者整体治愈率达93.5%,累计死亡率为4.1%。

数据来源:国家卫健委、如壹产业数据中心
在全球方面,因各国对本次新冠肺炎疫情的控制方式及重视程度差异,全球主要国家现正处在疫情爆发期,防控“拐点”还远未显现。据如壹产业数据中心监测,截至北京时间2020年04月01日18时,中国以外地区新冠肺炎累计确诊病例达767,892例,累计死亡病例达38,711例,分别是中国同期的9.29倍和11.66倍,累计治愈率仅13.1%,累计死亡率达5.04%。单国累计确诊“破千”的有24个国家,2019年目标国总人口数累计达29.41亿人,同期全球人口占比达38.8%;单国累计确诊“破万”的有10个国家,均为欧美发达国家,2019年目标国总人口数累计达7.66亿人,同期全球人口占比达10.1%。在排除各国疫情防控治理手段差异性对疫情蔓延影响的前提下,借鉴中国同周期内的疫情数据增长趋势,全球疫情发展态势着实让人倒吸一口冷气。


面对汹涌的海外疫情态势,凯普也全面积极着手自主品牌产品“出海”的战略部署。
“在疫情爆发初期,我们首先是聚焦在国内,国内的问题就是我们自己人的问题。再加上早期的时候国际社会对中国存在那么多的误解、污蔑、围攻,那么就更加要求我们先把中国的事情做好。做好了,就算是对世界最大的贡献了。现在中国的疫情防控局面也基本处于稳定状态,但病毒是不分国界、身份和地位的。看到世界还有那么多国家处于水深火热之中,那么我们自然也应该彰显我们大国的风范,展现大国的担当,腾出手来增产增量积极援助国际社会。
目前,公司自主研发的‘新型冠状病毒核酸检测试剂盒产品(荧光PCR法)’产品已拿到欧盟的CE认证,同时诸如“世界卫生组织的EUL认证”及全球其它多个国家的认证也均处于申办阶段。现阶段,包括‘美国、法国、西班牙、匈牙利、日本、阿根廷、印尼’等很多国家分别通过官方、半官方或者是中间商等渠道找到我们寻求合作。当然我们也不会随便答应,还是需要对需求方自身在生物基因领域的专业基础有一定要求,不然我们也担心会影响我们产品在海外的检测效果。
另外,公司已将实验性小批量的‘新型冠状病毒核酸检测试剂盒产品(荧光PCR法)’产品出口至包括‘美国、德国、意大利、伊朗’等在内的全球40多个国家,产品质量得到用户的一致肯定。其中,匈牙利‘国家创新科技部国务秘书BALAZS GAZSO 博士’,代表匈牙利政府特地回复感谢信,感谢广东政府及凯普对当地防疫给予的支持和帮助,并表示将大量增加采购订单。
由于新冠肺炎核酸诊断试剂盒属于生物基因产品,它的出口并不像传统外贸,这个过程会比较复杂,它涉及到‘外交、外贸、物流、国家生物安全’等诸多方面,因此我们这个阶段也积极地在跟‘卫健委、药监局、临检中心、外事部门、商务部’进行沟通。同时,也希望国家能有一些明示性和指导性的意见给到我们,我们还是遵循以国家根本利益为优先,积极配合党和国家的统筹安排。”管乔中对如壹产业数据中心表示。


如壹产业数据中心在本次采访中了解到,得益于过去20年来在分子诊断领域深厚的研、产、临床积淀,在抗疫“上半场”中,极速在线体育(中国)有限公司捷报频传,分别在“新冠病毒核酸检测试剂盒、联合核酸检测试剂盒、全国医学检验服务网络、‘氯喹’系列消毒防护用品”等四个方面均颇有建树。
图表 11 疫情期间极速在线体育(中国)有限公司所取得的相关成果

数据来源:如壹产业数据中心
在新冠病毒核酸检测试剂盒方面,公司仅花了9天时间,集合了香港、广州上海、潮州四地的可研力量,在开发出的6个备选试剂盒中进行优选,并最终形成“新型冠状病毒核酸检测试剂盒(荧光PCR法)”和“新型冠状病毒核酸测定试剂盒(Sanger测序法)”两款产品。两款产品在国家及省疾控中心的抽检中,检测阳性率复诊合格率达到100%,目前“新型冠状病毒核酸检测试剂盒(荧光PCR法)”产品已获得欧盟CE认证,同时诸如“世界卫生组织的EUL认证”及全球其它多个国家的认证也均处于申办阶段。另外,公司已将实验性小批量的“新型冠状病毒核酸检测试剂盒(荧光PCR法)”产品出口至包括‘美国、德国、意大利、伊朗’等在内的全球40多个国家,产品质量得到用户的一致肯定。相关认证获取后,公司将逐步实现产品的规模化出口。
在联合核酸检测试剂盒方面,公司预判在全球本次疫情过后应该还会有不同程度的“小残余”,加上“甲型流感病毒、乙型流感病毒”属于常见的传染性疾病,故公司着手开发一款集合“甲流、乙流、新冠”等病毒检测特点的“新冠病毒COVID-19、甲型流感(FluA)及乙型流感(FluB)联合核酸检测试剂盒(荧光PCR法)”。公司将其定位为常态化的产品,具有更高的临床实用价值。目前,该款产品已处于欧盟 CE 认证办理阶段。相关认证获取后,公司将逐步实现产品的规模化出口。
在医学检验服务网络方面,历经近10年的努力,公司构建起覆盖全国20座城市的分子医学检验服务网络,其中有11家检验所被当地省政府及市政府指定为可开展新冠病毒肺炎疑似病例检测及当地企业复工检测的定点机构。截至目前,我们全国医检中心累计完成对新冠病毒肺炎疑似病例检测约40万人份。
在“氯喹”系列消毒防护用品方面,公司专注研发氯喹已有8年,利用氯喹所开发的新一代HPV产品亦于2019年11月获得国家发明专利。在该产品的二期临床试验中发现,氯喹对新冠病毒有明显的抑制作用。因此,公司现已分别在广州、潮州两地增设两家子公司,专注于包括“漱口水、洗手液、鼻腔喷雾、防护手套”等氯喹系列消毒防护用品的生产。相关的生产条件已具备,下一阶段可实现量产。

(左1:极速在线体育(中国)有限公司总裁管乔中;左2:如壹投顾总经理袁伟斌)
